先给各位读者拜个晚公历年、早农历年。
去年写十问,开篇就和大家聊了癌症免疫治疗。一年过去,免疫治疗仍在话题中心,它的领地还在不断扩大,但一些问题也还没有拿到更好的解决方法。毕竟免疫系统本身就高度复杂,再加上肿瘤就成了复杂的平方。
今日《细胞》子刊《免疫》杂志刊登了一篇深度好文[1],依据基础科研到临床研究的顺序提出了癌症免疫治疗面临的十个待解决的问题,这里介绍给大家,权且作为提前的过年大餐。
留好胃口,马上开始。
可向人类转化的临床前模型
癌症药物的发现依赖于临床前研究模型。从药物的发现、作用机制的厘清、给药方法的探索再到安全性管理,实验室工作不可或缺,CTLA-4和PD-1的故事就是最好的例证。
但我们都清楚,临床前模型是无法完全反映人体免疫真实情况的。不空谈理论,举两个实例:常用的鼠结直肠癌模型MC38,它的高肿瘤突变负荷(TMB)能够反应结直肠癌超突变/微卫星不稳定(MSI)的特点,但是MC38的突变与人类常见的突变并不一致[2];而另一种结直肠癌模型CT26,虽然特征与未分化/难治性人类结直肠癌一致,但却同时具有内源性逆转录病毒免疫显性抗原,免疫原性更高[3]。
除去小鼠本身与人类的差异,制作模型的方法也会造成结果的分歧。
临床前常用癌症模型往往依赖于皮下植入,而这样生长起来的肿瘤既无法完全再现人类肿瘤免疫的全部特征,也无法反映肿瘤在复杂组织和器官中发育的图景;再加上,现在普遍认为肿瘤是以年为单位长期发展的,简单的植入显然不能够反映时间构筑起的肿瘤-免疫相互作用。
那么基因工程小鼠能解决问题吗?也是不能的。
利用Cre-LoxP系统敲除抑癌基因或诱导体细胞突变,这种技术已经给我们提供了可自发生长肿瘤的小鼠[4],但这又与人类癌症突变自然积累的特征不甚相同,仅能够代表一部分遗传稳定的癌症。
可以说,截至目前临床前模型的转化能力都是很有限的。

图源 | pixabay
临床前解决不掉的问题,就只能留到临床研究去解决。但免疫治疗要考虑的问题如此之多,通过排列组合设计临床方案来一步步优化几乎是不可能的。这就是为什么类器官研究这么火的原因了。
当然,除了类器官,还有很多可以探索的新模式,比如说人源化小鼠/基因改造小鼠、肿瘤干细胞前体细胞培养、离体培养技术等等。其中离体人类肿瘤外植体很值得关注,因为它能够结合免疫染色和实时成像技术,来观察肿瘤与免疫细胞的相互作用[5]。
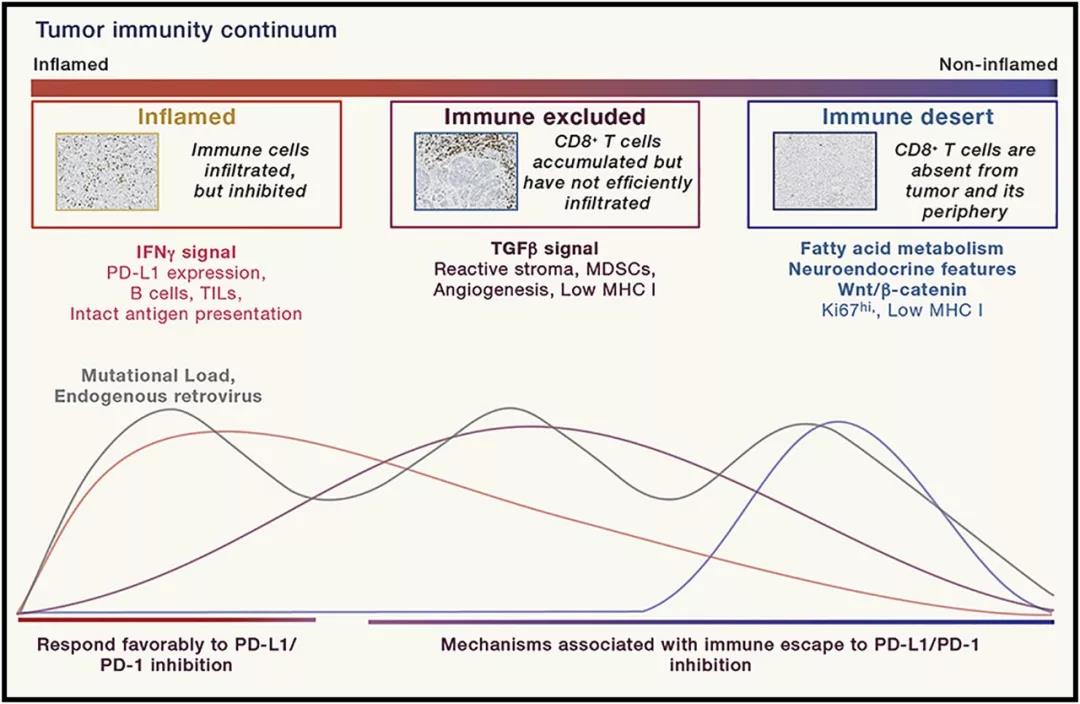
而这些技术仍是要面临复杂的免疫环境。肿瘤微环境(TME)由多种细胞共同构建,形成了多种多样的类型。比较简单的一种分类将肿瘤微环境分为三类:炎症表型、免疫沙漠和免疫排斥,Thorsson等人更是进一步分出了六大免疫亚型[6]。
最后,从临床研究寻找科学缺陷、反哺临床前模型也是值得探索的。
三种免疫表型
肿瘤免疫的主要驱动因素
上一节说到肿瘤的三种免疫表型,炎症表型、免疫沙漠和免疫排斥。炎症表型基于高PD-L1表达/高肿瘤浸润淋巴细胞,也就是通俗所说的“热肿瘤”。之所以关注热肿瘤,正是因为这份温度与肿瘤对免疫检查点抑制剂(CPI)的反应息息相关。
除了PD-L1,目前还发现了一些其他的热肿瘤标志物,包括IFNγ、B细胞、微卫星不稳定/肿瘤突变负荷代表的基因组不稳定等等。其中微卫星不稳定/肿瘤突变负荷可以说是非常受关注的标志物。
从机制上来说,这二者所代表的基因组不稳定性是肿瘤新抗原的来源,可以诞生更有效的抗肿瘤T细胞反应。在转移性膀胱癌、非小细胞肺癌、结肠癌和其他几类癌症中,科学研究已经证明高肿瘤突变负荷代表着更好的免疫治疗反应,不过这是否能够等同于更长的生存获益还没有定数[7]。
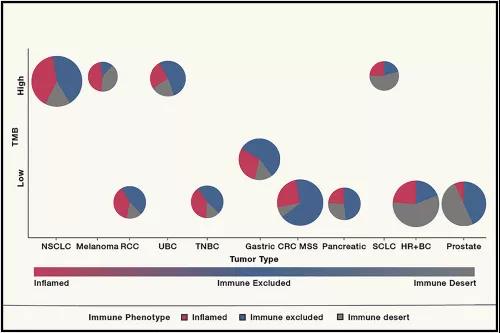
但肿瘤突变负荷并没有与热肿瘤绑定。包括肾细胞癌、肝细胞癌、三阴性乳腺癌、胃癌、部分头颈癌在内,这些癌症在没有高肿瘤突变负荷的情况下也表现出热肿瘤的特征;而小细胞肺癌等癌种则具有高肿瘤突变负荷,同时缺乏热肿瘤特征。
现在科学界已经发现病毒在新抗原产生中的作用,从内源性逆转录病毒,到更为人所知的EB病毒、乙/丙型肝炎病毒、HPV等等病毒,尽管它们的存续状态与免疫检查点抑制剂的疗效暂无明确关联,但病毒基因组整合进入宿主基因组已经是得到证明的事实。
免疫排斥表型则具有明显的免疫抑制特征,可想而知,免疫排斥肿瘤对免疫检查点抑制剂的反应是比较差的。在免疫排斥表型中,TGFβ信号是主要的促进因素[8],其他的诸如IL-8、IL-6等细胞因子也很常见。至于免疫检查点抑制剂与细胞因子抑制剂的组合是否能够打破免疫抑制,那就是现在进行的临床试验正在探索的了。
最后,免疫沙漠指的是无免疫浸润、肿瘤增殖较快的肿瘤,包括一些小儿恶性肿瘤、HR+乳腺癌、前列腺癌、胶质母细胞瘤和小细胞肺癌。除了小细胞肺癌,其他癌种对免疫检查点抑制剂普遍反应较差。
免疫沙漠表型的潜在驱动因素比较复杂,尚不清楚。除了缺乏启动免疫监视的信号之外,免疫沙漠还会进一步改变肿瘤微环境的代谢条件,导致不利于T细胞功能的环境。但通过代谢来做出改变也不那么容易,因为T细胞与癌细胞会利用类似的糖酵解途径[9],靶向代谢的抗癌药物可能也会影响T细胞的功能。
这部分问题如何解决,可能就要看PI3K/AKT/EGFR3等候选靶点的效能有多大了。
各个癌种中都存在不同比例的三种表型
特定器官肿瘤的免疫情况
从本质上来讲,肿瘤的生长力取决于肿瘤细胞的内在特征和肿瘤所处的位置[10]。举个简单的例子,转移性尿路上皮癌如果处于肝脏更可能耐药,处于淋巴结则更可能响应免疫检查点抑制剂。不可否认,肿瘤所在的位置也是免疫方程式的重要变量。
考虑不同免疫区室和不同组织内的免疫条件,免疫治疗、肿瘤位置、原发瘤位置,这三者的组合相性可说是未知满满。这里不再举更多具体的例子了,因为尽管转移灶的不同与预后之间有明确的联系,但临床上普遍并不考虑器官特异性的治疗方法。
从目前的一些研究结果来看,肝脏存在着比较明显的器官特异性免疫,此外抗肿瘤免疫在骨髓中也会受到特殊的抑制,而淋巴结、肺、皮肤等部位可能对抗肿瘤免疫更有利。
两种耐药的细胞和分子机制
在免疫检查点抑制剂的临床使用中,存在两类“耐药”问题。部分患者在最开始就不响应免疫检查点抑制剂,而另外少部分患者则是在使用免疫治疗之后逐渐出现耐药性。
前者与我们前文介绍的肿瘤免疫状态有关。免疫排斥肿瘤是免疫治疗效果比较差的,但在不同的癌种中,这种耐药的机制也有不同。
比如,针对TGFβ信号增强的免疫排斥尿路上皮癌,免疫治疗结合TGFβ抗体能够一定程度上克服耐药;不过在肾细胞癌中,免疫抑制主要是由于髓样炎症,此时加入贝伐单抗则是合理的解决方案[11]。
简而言之,这种原发的耐药似乎可以按照免疫表型分类,解决思路也要从免疫表型的驱动因素中寻找。
继发的耐药机制则更加难寻。有研究表明,肿瘤可能会诱导抗原递呈机制的变化,包括JAK-STAT信号突变、MHC表达下调、抗原丢失等等[12]。
原发耐药可以从已有的肿瘤标本中寻根,而且它可能更多地取决于患病器官和细胞的生物学特性;继发耐药则更可能在免疫治疗的间隙出现,对它的理解还需要更多的临床样本,以及更多的时间。
两类免疫治疗的优势
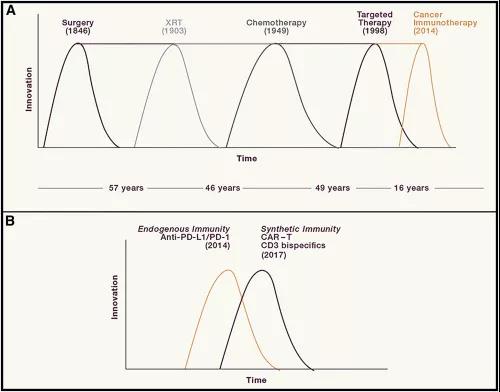
这里所说的两类免疫治疗,第一大类是以PD-1/L1抑制剂为代表的,驱动内源性免疫细胞的内源免疫治疗。这种方法很大程度上依赖于已经存在的特异性识别癌细胞的CD8+T细胞,通过免疫治疗增强其抗肿瘤活性。
但并不是所有的癌种都存在足够供内源性细胞识别的抗原,有的癌种还会利用MHC下调来逃避免疫。这种情况下便出现了以CAR-T和CD3双特异性抗体为代表的合成免疫治疗。前者为T细胞人工引入抗原,后者则借助抗体给T细胞和癌细胞说媒。
与内源免疫不同,合成免疫可以使免疫原性差的癌症产生抗肿瘤免疫。不过合成免疫也常导致PD-L1表达的增加,反过来抑制合成免疫的效果[13]。另一方面,内源免疫能够激活多种特异性免疫反应,可以形成持久的抗肿瘤反应,这是合成免疫不一定能够做到的。
合理猜测,内源免疫与合成免疫可能存在相辅相成的作用。不过这两者能否成功携手,还有很多的很基础的问题需要考虑,特别是免疫相关的不良反应,应当慎之又慎。
早期临床对免疫组和疗法的评估
目前可能的免疫疗法组合已经超过了1000种[14],如何在尽早的阶段快速找到有潜力的组合很重要。这就又要回到第一个问题,对临床前研究模型的优化,这里不再重复讨论了。
其实我们现在对免疫治疗的理解还很浅,免疫治疗可能对免疫的很多节点都存在直接或间接的作用,那么在哪个节点去评判、用什么标志物作为标准也需要从头思量。考虑到治疗组合评估的难度,更好的随机化设计以及更多的检测方法也该纳入其中。
从机制上来说,免疫治疗组合并不需要每一个组分都有单独的活性,比如某些抗癌疫苗主要是为了激活另一种药物的敏感性。不过目前的临床研究探索更多地集中于具有单独活性药物的组合。
类固醇对免疫治疗的影响
皮质类固醇直接影响免疫力,且对T细胞的影响甚于B细胞,各类型亚组影响不同,总的表现为T细胞总数减少[15]。皮质类固醇用于治疗自身免疫性疾病、移植物抗宿主病,同时也是免疫治疗免疫相关不良反应的常用药。
从机制上来说,鉴于类固醇对T细胞的抑制,类固醇很可能会降低免疫治疗的效果。相关的临床研究,我们有过一篇很详细的报道,可以点击查看。另外一篇研究则认为,这些经历过自身免疫不良事件的患者可能会具有更强的免疫反应能力[16],这会使得他们对免疫治疗的反应与常人不同。
类固醇与免疫治疗间的关系到底如何,它对长期预后的影响怎样,临床使用是否要做出变革,这都是需要进一步探索的问题。
预后的生物标志物
哪些患者适用免疫治疗?生物标志物本身已经讨论太多,这里再提几点“外围”问题:采样组织的获取和保存形式?生物标志物组合的性价比?检测手段/工具的可及性?医疗成本?范式的确定?
还得慢慢来。
更好的临床终点
相信关注免疫治疗的读者都有发现,传统临床研究的ORR、PFS、OS等终点,并不是十分适用于评估免疫治疗。
从治疗目的来说,使用免疫治疗是为了持久的治疗效果和更长的生存期,但是在目前的临床研究评估体系里,还缺乏对应的方法。没有分析手段,则需要更长时间的随访才能获得有力的结论[17]。
此外,免疫治疗有着特殊的临床进程,比如说治疗的延后效应和假进展,这也是ORR和PFS无法公正评估的。
不幸的是,短时间内我们可能还无法看到合适的新评估方法。目前已经有几种新标准提出[18-20],不过它们还需要大量的临床数据验证和不断的修改。
多药组合优化生存
抗肿瘤免疫节点颇多,未来最佳的免疫治疗方案很可能并非单独的某个疗法,而是多种治疗多管齐下,同时调控每个环节。
如果按照这种思路,完整的治疗方案可能包括对癌细胞的杀伤、降低肿瘤负荷、增加肿瘤对免疫疗法的敏感性、激活内源免疫反应、促进免疫细胞浸润、维持长期免疫以延长生存曲线等等。
实现以上目标,可以考虑的手段包括解放免疫检查点、寻找可用的新抗原、克服免疫排斥、增加Ⅰ类MHC分子、增加T细胞存活,以及联合放化疗等细胞毒性疗法。
新的组合要在药物剂量上多做考虑,有些药物可能不需要全程给药,就能够产生足够的治疗收益。总的来说要避免生物毒性,最大程度发挥协同效应。先例可以参考经典的化疗组合,当然在有免疫治疗参与的情况下方案会更加复杂。
多药方案的确定需要新的试验方法,例如伞式试验、平台试验和篮子试验。这类研究方法允许更加灵活的药物组合切换。真实世界数据也能为临床试验提供适当的对照组。
结语
癌症免疫治疗想要继续前行,这十座大山必须越过,至于它们中的优先次序,那就见仁见智了。从历史的角度来看,癌症治疗范式转移的间隔正在不断缩短,我们也希望能在2020年迎来免疫治疗的大突破。
(这么好的开源论文,建议赶紧顺着参考资料1去下载)
编辑神叨叨
全体奇点糕呕心沥血呕心沥血呕心沥血打造的重磅音频课程《医学趋势50讲》终于上线了。我们一口气帮你同步了全球医学前沿领域最重磅的进展。只需500分钟,让你彻底搞懂最重磅的医学前沿进展。
课程亮点如下:
1、全面:一网打尽最重磅的医学前沿进展。
在这套《医学趋势50讲》中,我们囊括了免疫治疗、干细胞、微生物、人工智能、二代测序,抗癌新药研发等15个重要的前沿领域,帮你将全球最顶尖的科研成果一举收入囊中。
2、紧跟趋势:帮你无缝同步全球认知。
奇点跨学科专业知识团队,依靠强大的自有数据库系统,每天跟踪全球3000多本医学与生命科学领域的重要期刊,实时把握医学前沿科技最强劲的脉搏。和全球认知同步,你不需要费心费力,我们把全球脉动送到你的耳边。
3、有趣易懂:不用绞尽脑汁,就能理解全球医学顶尖难题。
医学和生命科学领域的论文往往晦涩难懂,再加上语言的隔阂,导致很多人对此望而却步。这一次,我们帮你把艰深晦涩的前沿学术调制成清新爽口的科学小品,让你在享受科学之美的同时,轻轻松松理解医学顶尖难题。和全球最聪明的大脑思考同样的问题,你也可以。
