疼痛是包含感觉、情感和认知等不同维度的复杂现象。疼痛的持续存在会导致负性情感状态。负性情感的一个共同特征是快感缺失,表现为对目标导向行为缺乏开始或完成的动机。
腹侧被盖区(VTA)投射到伏隔核(NAc)的多巴胺通路在奖赏处理和动机行为中发挥重要作用。患者的影像学研究和啮齿类动物研究均表明疼痛引起NAc中多巴胺释放的减少。但疼痛通过何种神经环路、如何影响这一中脑边缘多巴胺通路尚不清楚。
近日,圣路易斯华盛顿大学疼痛中心Jose Moron团队和Meaghan Creed团队在Nature Neuroscience发表原著论文,揭示了疼痛通过降低VTA多巴胺神经元的活动,引起快感缺失样行为。

该研究在CFA诱导的炎症性疼痛大鼠模型中,利用在体钙成像记录、离体脑片电生理记录和化学遗传学等手段,揭示了疼痛通过增强吻内侧被盖核(RMTg)投射到VTA多巴胺神经元的抑制性突触传入,降低VTA多巴胺神经元的兴奋性,导致大鼠获取蔗糖奖赏的动机行为的降低。
首先,研究人员训练大鼠通过压杆获得蔗糖奖赏,在progressive ratio(PR)试验中,获得奖赏所需要的压杆次数以指数级递增,因此大鼠最终获得蔗糖的次数可作为评估奖赏动机行为强度的指标。
研究人员利用TH-cre大鼠构建CFA疼痛模型,在PR试验中对VTA多巴胺神经元进行在体钙活动记录,发现CFA鼠在PR试验中获得的蔗糖次数显著降低,VTA多巴胺神经元的钙瞬变频率显著降低。但在获得奖赏时,CFA鼠的VTA多巴胺神经元的钙活动显著增加。
以上结果表明CFA引起大鼠获得蔗糖奖赏的动机行为降低,VTA多巴胺神经元总体钙瞬变频率降低,但对奖赏响应时的钙活动升高。
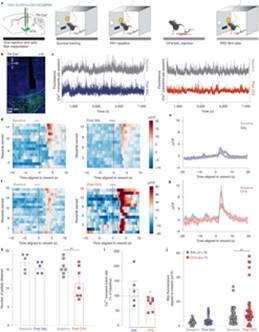
图1:CFA降低VTA多巴胺神经元的钙瞬变频率但增强获得奖赏时的时相性反应
对CFA鼠进行VTA脑区的离体电生理记录,研究人员发现VTA多巴胺神经元的静息膜电位显著降低,基强度显著升高,且二者可被GABAA受体拮抗剂所拮抗。
对自发性IPSC的记录表明CFA显著增加自发性IPSC的频率,而不改变幅值。因此,该结果表明CFA通过增加抑制性突触传入降低VTA多巴胺神经元的兴奋性。
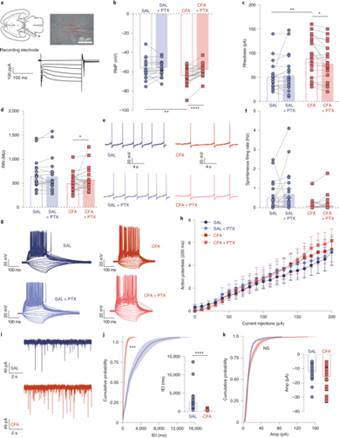
图2:CFA导致VTA多巴胺神经元超极化,内在兴奋性降低,自发性IPSC频率增加
研究人员接下来利用化学遗传学分别激活VTA多巴胺神经元、VTA投射到NAc的神经元、VTA投射到NAcSh的多巴胺神经末梢,均发现CFA导致的动机行为的降低可被拮抗,而热痛阈值不受影响。
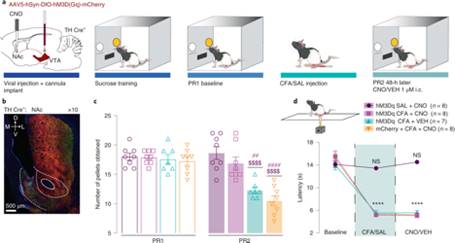
图3:化学遗传学激活VTA投射到NAcSh的多巴胺神经元末梢可拮抗CFA导致的动机行为降低
研究人员进一步利用水-糖水自由选择任务,探究CFA是否影响对不同奖赏价值的糖水的偏好。分别利用5%、30%和60%蔗糖溶液,研究人员发现CFA显著降低大鼠对5%或30%糖水摄入量,而不影响60%糖水摄入量,而化学遗传学激活VTA多巴胺神经元能够拮抗对5%糖水摄入量的降低。
以上结果表明疼痛导致蔗糖奖赏价值“右移”,而激活VTA多巴胺神经元能消除“右移”。
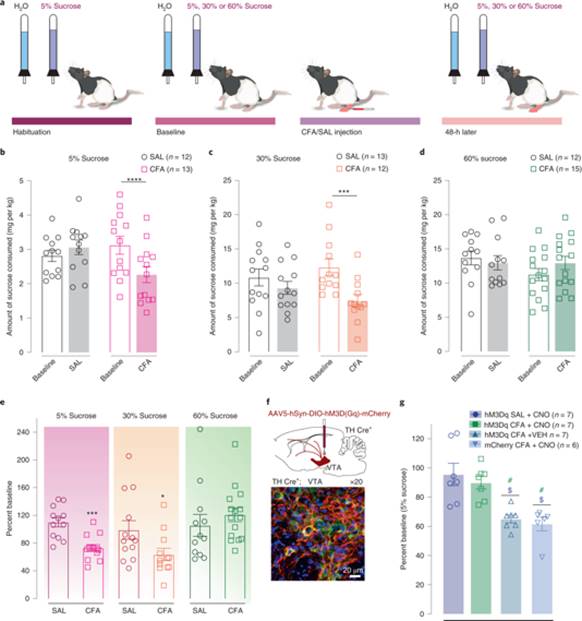
图4:增加糖水浓度能拮抗CFA导致的糖水摄入降低
由于RMTg脑区是VTA多巴胺神经元的主要抑制性突触传入之一,研究人员设想疼痛可能增加RMTg对VTA多巴胺神经元的GABA能传入。在RMTg的GABA能神经元中表达ChR2后,构建CFA疼痛模型后,对VTA多巴胺神经元进行离体电生理记录,研究人员发现CFA显著增加了RMTg投射到VTA多巴胺神经元的GABA释放概率。
通过化学遗传学激活RMTg的GABA能神经元能够降低naïve大鼠的糖水摄入量,而抑制RMTg的GABA能神经元能够拮抗CFA导致的糖水摄入量的降低。以上结果表明RMTg的GABA能输入对于降低动机行为是充分且必要的。
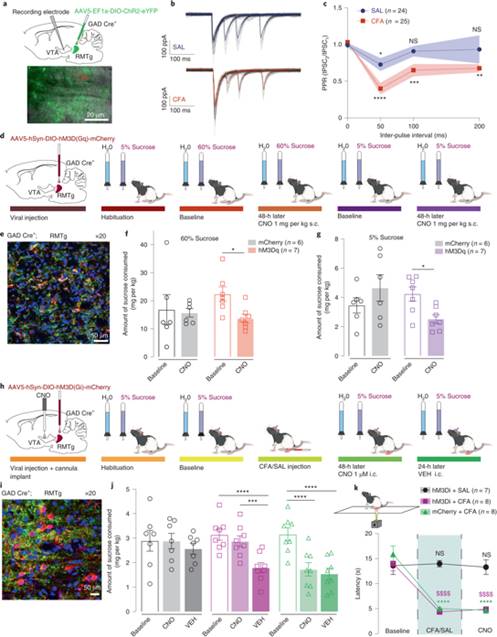
图5:CFA增加了RMTg的GABA能神经元投射的GABA释放概率
总结
综上,该研究揭示了疼痛通过增强RMTg脑区对VTA多巴胺神经元的抑制性突触传入,引起中脑边缘多巴胺通路改变,导致快感缺失样行为。
同时需要注意的是,本研究仅在疼痛早期观察到对蔗糖奖赏的动机行为降低和VTA多巴胺神经元兴奋性的降低,因而慢性疼痛伴随的快感缺失应该还有其他机制参与介导。总之,该研究揭示了中脑边缘多巴胺系统是疼痛导致负性情感的重要神经环路机制。
来源:文章转载于brainnews
