
衰老和疾病过程中的骨质流失与成骨和破骨作用的失衡有关。在这里,我们表明,小鼠骨骼干细胞(SSC)的固有老化改变了骨髓微环境中的信号传导,扭曲了骨骼和血液谱系的分化,导致脆弱的骨骼再生不良。从功能上讲,衰老SSC的骨和软骨形成潜能降低,但产生更多的基质谱系,表达高水平的促炎症和促吸收细胞因子。单细胞RNA测序研究显示功能丧失与衰老小鼠SSC转录组多样性减少直接相关,这导致了骨髓微环境的转化。通过异时共生实验或年轻造血干细胞的系统重建将老年SSC暴露于年轻循环中,不会逆转其骨软骨生成活性的降低,也不会改善老年小鼠的骨量或骨骼愈合参数。相反,衰老的SSC谱系通过造血干细胞和祖细胞促进破骨细胞活性和髓样倾斜,表明SSC的老化是造血老化的驱动因素。老年小鼠骨再生不足能够通过局部应用BMP2和CSF1拮抗剂的组合治疗恢复到年轻水平,从而重新激活老年SSC,同时清除炎症、促破骨细胞环境。我们的研究结果为骨骼老化的复杂、多因素机制提供了机制上的见解,并为老年骨骼系统的再生提供了前景。
主要发现:
1.骨骼干细胞的功能衰退来源于细胞本身的变化而非环境。
2.骨骼干细胞的老化直接导致造血系统出现年龄相关性的髓系偏移。
3.老年骨骼干细胞的功能衰退是转录组多样性丧失的结果。
4.用BMP2结合低剂量aCSF1治疗,能够使老年骨骼恢复到年轻的再生水平。
结果展示:
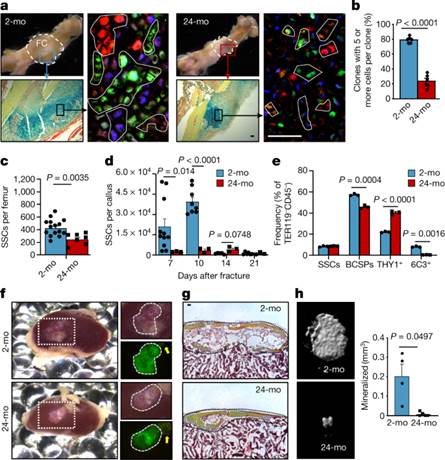
图1:年龄相关性骨质流失与骨骼干细胞功能的改变相一致。
a,具有代表性的大体图像,显示骨折后第10天(左上)肌动蛋白CreERT Rainbow小鼠的骨折骨痂(FC),2个月大(2-mo)和24个月大(24-mo)小鼠用Movat五色染色(左下)和荧光克隆(右)染色的放大的外部骨痂区域。
b,克隆大小的量化。对来自每个年龄组的两只小鼠的六个不同的愈伤组织区域(每个切片5-19个克隆)进行计数。
c,流式细胞术定量分析每根未受伤股骨的SSC(2个月,n= 15;24个月,n= 7)。
d,2月龄和24月龄小鼠在骨折损伤后不同天数的SSC患病率(2个月,第7天n= 11,第10天n= 7,第14天n = 5,第21天n = 6;24个月,n= 3)。
e,流式细胞术分析2月龄和24月龄小鼠新鲜分离的SSC的谱系输出。细胞培养六天(每个年龄n = 3只小鼠)。
f,来自2月龄和24月龄小鼠的GFP标记的SSC的4周肾囊移植物。肾脏(左)和放大移植物作为明场图像显示GFP信号(右)。黄色箭头表示自发荧光胶原海绵(不是移植物的一部分)。
g,用Movat五色染色的移植物切片。
h,代表性μCT图像(左)和肾移植物矿化的量化(右)(2月龄,n = 4;24月龄,n= 5)。
所有比较均采用双侧Student-t检验,并在适当情况下根据非正态性(Mann–Whitney检验)或不等方差(Welch检验)进行调整。数据为平均值+s.e.m.有关精确的P值,请参阅源数据。比例尺,50μm。
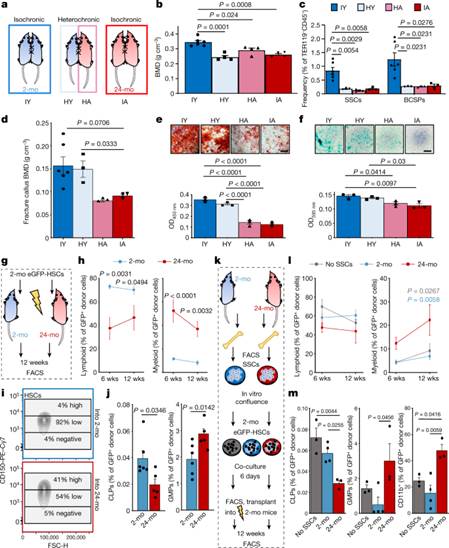
图2:SSC谱系导致造血谱系的年龄相关性倾斜。
a,2月龄(等时年轻; IY)和24月龄(等时年老;IA)等时配对以及2月龄(异时年轻;HY)与24月龄(异时老化;HA)小鼠的异时配对共生实验示意图。
b,共生4周时的骨密度BMD(IY,n=6;HY、HA、IA,每组n=4)。
c,共生4周时SSC和BCSP的频率。
d,共生小鼠骨折后第10天的骨密度BMD(IY,n=6;HY,n=3;HA,n=3;IA,n=3)。
e,在骨折后第10天,来自联体共生小鼠的SSC的体外成骨染色(顶部)和量化(底部)。光密度OD 450 nm。
f,相同SSC的体外软骨形成(每组n = 3)。
g,将GFP标记的HSC从2月龄小鼠的骨髓移植到经致命辐射的2月龄或24月龄小鼠体内的示意图。
h,造血重建后6周(wks)和12周的外周血淋巴细胞(B细胞和T细胞)和髓细胞(GR1+)组分分析(2月龄,n= 6;24月龄,n=5)的外周血分析。
i,CD150(SLAM)在供体来源的GFP + LIN - cKIT + SCA1 + FLT3 - CD34 -骨髓HSC中的表达。
j,流式细胞术(2-mo,n= 6;24-mo,n= 5)对12周时供体来源的(GFP + )造血细胞群进行骨髓分析。CLP,共同淋巴祖细胞;GMP,粒细胞-单核细胞祖细胞。
k,SSC-HSC共培养实验示意图。
l,用共培养的造血细胞进行造血重建后的外周血分析。
m,12周时对共培养的供体来源(GFP + )造血细胞群的骨髓分析(无SSC,n=3;2个月,n=4;24个月,n =3)。
b–f,m中数据为的平均值+s.e.m.统计检验,通过单因素方差分析和Tukey的事后检验进行所有比较。
j,根据非正态性调整双侧学生t检验(Mann–Whitney检验)。
h、i,采用Bonferroni事后检验的双因素方差分析。
有关精确的P值,请参见源数据。比例尺,50μm。
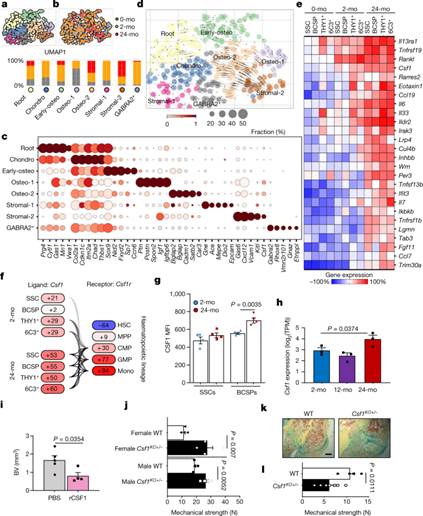
图3:促炎症老化骨骼谱系通过CSF1驱动增强的破骨细胞活性。
a,均匀流形近似和投影(UMAP)图,来自出生后第3天(0月龄)、2月龄和24月龄小鼠的单细胞的Smart-seq2 scRNA-seq组合的Leiden聚类。
b,按年龄(顶部)对同一UMAP图进行聚类,显示按年龄排序的单细胞在Leiden聚类(底部)内的分布。
c,点图显示每个Leiden聚类的标记基因。
d,使用Leiden聚类标记细胞RNA的速度轨迹推断分析。
e,用于表达纯化骨骼谱系群体的促炎和促骨髓或促破骨细胞基因的大量微阵列数据的热图。Wisp3也称为Ccn6.每个细胞群反映了三到五只小鼠的混合样本的表达。
f,配体(Csf1)和受体(Csf1r)微阵列分别在2月龄和24月龄的SSC谱系和造血谱系中表达大量基因(百分比)。MPP,多能祖细胞;CMP,常见髓系祖细胞;单核细胞。
g,通过Luminex测定法测量2月龄和24月龄小鼠(每组n = 4)的SSC和BCSP培养物上清液中的CSF1蛋白水平。MFI,中值荧光强度。
h,2月龄、12月龄和24月龄小鼠(n=3)第10天骨折骨痂纯化SSC的大量RNA测序数据中Csf1的表达。TPM,每百万中的抄本数。单边student-t检验以比较老龄组与2月龄组。
i,用PBS或5μg重组CSF1(rCSF1)(PBS,n = 5;rCSF1,n = 4)局部处理的第10天骨折愈伤组织的骨体积(BV)的μCT分析。
j,来自15个月大的单倍体Csf1基因敲除( Csf1 KO )小鼠与野生型(WT)小鼠(每组n = 4)的未受伤股骨的机械强度。
k,l,对15个月大的Csf1 KO和野生型小鼠(野生型,n=4;Csf1KO,n=7)第21天骨折骨痂组织进行的Movat五色染色(k)和相同骨痂的机械强度(l)。
在适当的情况下(g,i,j,l),对不相等方差进行调整的双侧student-t检验(韦尔奇检验)。数据为平均值+s.e.m.有关精确的P值,请参阅源数据。比例尺,150μm。
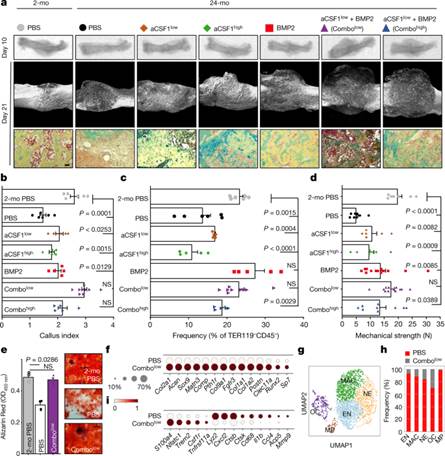
图4:老年骨骼微环境的组合靶向恢复年轻的骨折再生。
a,骨折后第10天股骨的放射学图像(顶部)和骨折后第21天骨痂的μCT重建(中部)。底部,愈伤组织切片的Movat五色染色。
b,骨折后第10天的愈伤组织指数。
c,第10天的SSC频率(2-mo PBS,n= 6;PBS n= 6;CSF1低,n= 5;CSF1高,n= 5;BMP2,n= 5;联合低组,n= 9;联合高组,n= 5)。
d,骨折第21天骨的机械强度测试(2-mo PBS,n = 7; PBS,n= 8;CSF1低,n= 6;CSF1高,n= 7;BMP2,n= 13;联合低组,n= 12;联合高组,n= 9)。
e,第10天SSC的体外成骨(每组n = 4)。数据为2月龄PBS组和每个24月龄组之间的平均值+s.e.m.双侧Student-t检验,并在适当情况下调整非正态性(Mann–Whitney检验)(NS,不显著)。
f,点图显示24月龄PBS和联合低组骨折骨痂的10X scRNA序列中骨软骨形成基因的表达;非造血细胞的子集。
g,对造血基因表达富集的细胞组分(髓系祖细胞(MP)、破骨细胞(OC)、早期中性粒细胞(EN)、中性粒细胞(NE)、巨噬细胞(MAC))的10X scRNA-seq数据集进行Leiden聚类。
h,每个Leiden聚类的治疗组细胞分数的百分比。
i,点图显示OC簇中的早期和晚期破骨细胞基因表达。
有关确切的P值,请参阅源数据。比例尺,50微米。
总结:
衰老过程与干细胞之间存在千丝万缕的关系,究竟怎样的细胞变化导致了骨骼的衰老,是逆转衰老表型的关键。文章对骨骼干细胞和造血干细胞进行了深入的研究,证实了骨骼的老化根植于干细胞的内在改变,并将骨骼和造血联系起来,阐明了它们之间的相互作用,以及确定了有效的靶向治疗方案。总的来说,这篇文章揭示了骨骼衰老的一些特质,使我们对于衰老过程有了更深的理解。
原文链接:https://www.nature.com/articles/s41586-021-03795-7
来源:骨生物力学,作者罗盛
