文章标题“Allele-Specific Chemical Rescue of Histone Demethylases Using Abiotic Cofactors”,文章作者:匹兹堡大学的Kabirul Islam课题组。
在这篇文章中,作者设计了一种利用合成辅助因子特异性激活同源蛋白的策略,并将其成功应用于KDM4家族蛋白,实现了组蛋白位点和程度特异的去甲基化调控。
细胞中存在许多由共同祖先基因演化而来的同源蛋白质,这些蛋白质在折叠和功能上具有高度相似性,因此开发针对他们的蛋白特异性化学探针具有极大的困难。赖氨酸去甲基化酶(Lysine demethylases, KDMs)是一类α-酮戊二酸(alpha-ketoglutarate, αKG)依赖型的双加氧酶,其去除组蛋白的甲基化修饰,从而调控基因表达。细胞中存在超过30种赖氨酸去甲基化酶参与了从染色质重塑到细胞分化过程中的核重编程等多种细胞过程,此外KDMs的过度表达和突变也是多种癌症的标志。因此特异性对单一KDM进行精细调控对于调节细胞生理过程十分重要。在本文中,作者们对KDM4进行了单位点突变从而使其仅在外源添加αKG衍生物的条件下发挥酶活,进而发展了正交的去甲基化酶-辅基作用对,实现了KDM4的特异性调控,为解析其功能提供了帮助(图1)。
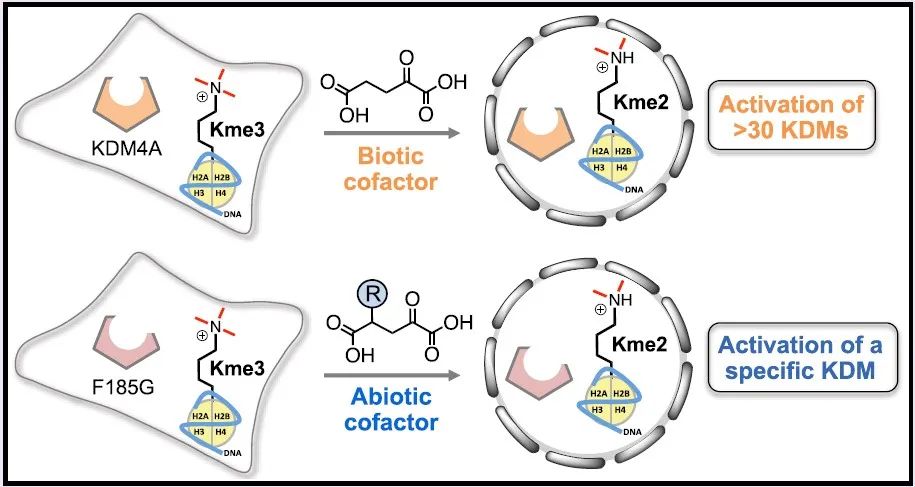
图1.正交的去甲基化酶-辅基作用对特异性调控特定KDM4示意图。
首先,基于蛋白质结构和该课题组此前的研究结果,作者们得知KDM4的F185G突变可得到对天然αKG失去响应的突变体,而仅当与C4携带基团的αKG衍生物结合时,其才能通过空间互补性恢复酶活。因此他们从天然αKG出发,利用较短的合成路线制备了携带多种基团的衍生物(图2)。
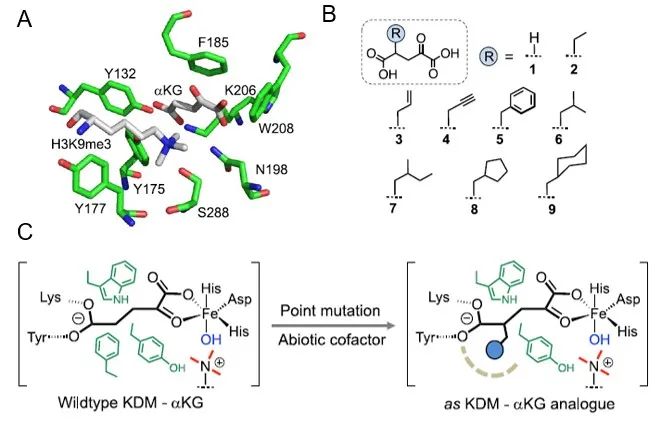
图2. A. KDM4A的αKG和H3K9me3结合催化结构域的晶体结构;B.多种αKG衍生物结构;C. WT KDM-αKG及KDM突变体-αKG衍生物的相互作用示意图。
之后,作者们表征了多种αKG衍生物对F185G突变体的去甲基化酶活的影响。结果显示,大多数衍生物均可不同程度的激活KDM4A F185G而不作用于野生型KDM4A,证明了突变型去甲基化酶与部分辅基的正交性(图3.A)。此外,作者们还测试了这些正交去甲基化酶-辅基作用对的催化效率,动力学参数显示F185G突变体-乙基αKG具有最高的催化活性(图3.B),且这些αKG衍生物并不影响细胞内其他酶的活性,证明了其极佳的正交性(图3.C)。
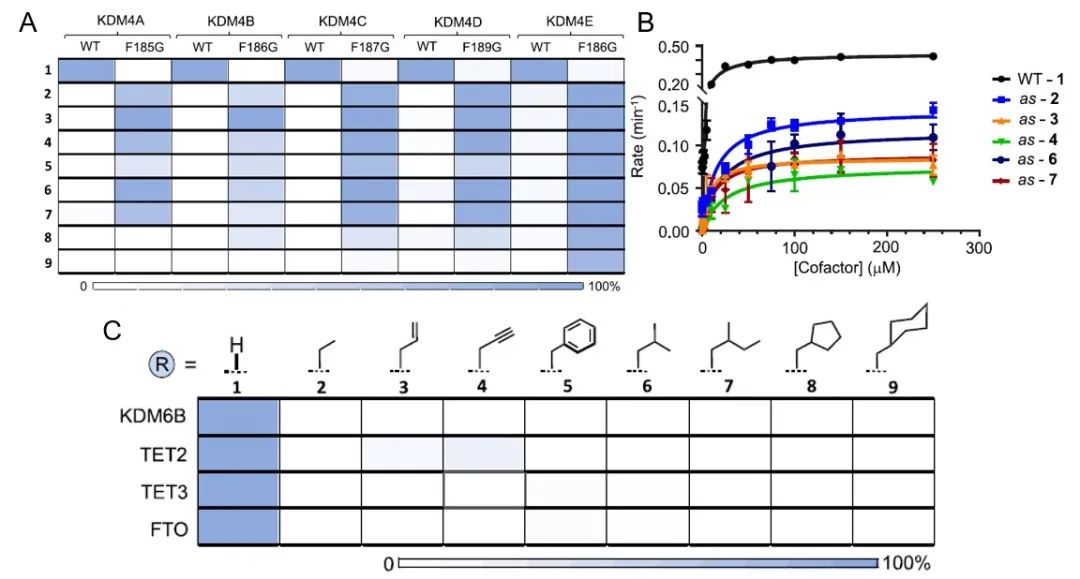
图3. A. KDM4A−E及其相应突变体响应αKG及其衍生物的活性表征;B.野生型及突变型KDM4A的动力学参数分析;C.αKG及衍生物对多种去甲基化酶的正交性测试。
接下来,作者们进一步探究了KDM4AF185G突变体对全长组蛋白H3去甲基化作用。作者们分别在体外及细胞环境中验证了正交去甲基化酶-辅基作用对的催化效率,实验结果显示,无论是在体外还是在具有超过60种天然αKG依赖型生物酶的复杂细胞环境中,该正交作用对均可以有效发挥其功能,并且具有位点和程度特异性(图4)。
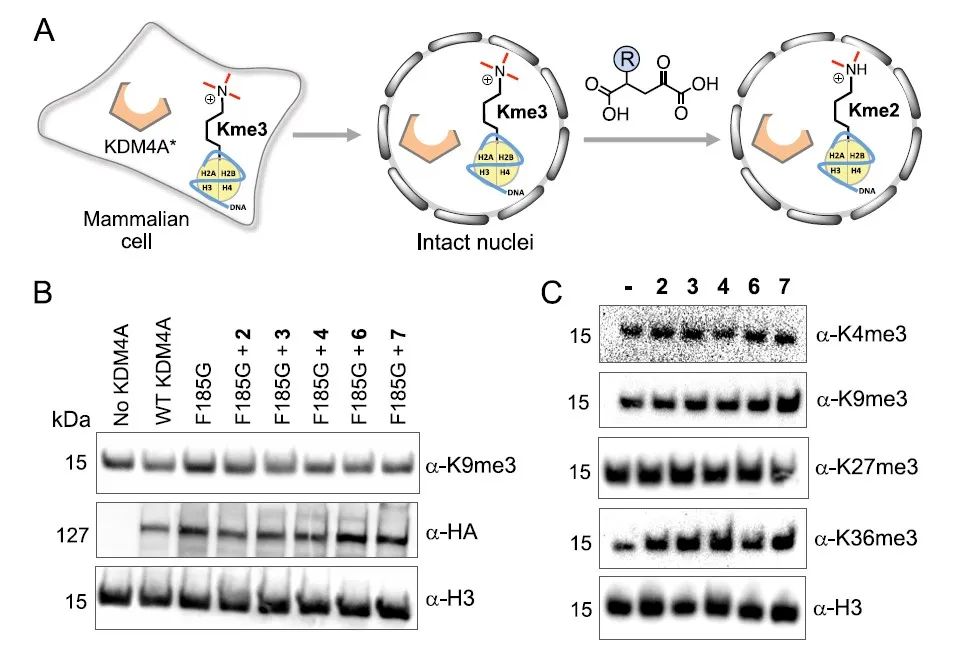
图4. A.正交去甲基化酶-辅基作用对催化组蛋白H3去甲基化修饰的示意图;B.多种正交作用对均可成功催化组蛋白去甲基化修饰;C.细胞内源野生型KDMs对αKG衍生物无响应。
总之,这篇文章通过设计去甲基酶-辅基正交对实现了去甲基化酶KDM4突变体的特异性激活,从而得以在体外及细胞环境中对全长组蛋白H3进行位点和程度特异性的甲基化修饰调控。但本文中所制备的αKG衍生物具有较差的细胞膜穿透性,因此其体内应用较为受限。后续作者们将对其进行进一步优化,以期在细胞内应用该方法特异性调控组蛋白甲基化修饰从而调控基因表达等多种生理过程。
