这篇文章中,为了探究糖基化修饰是如何调控趋化因子CCL14活性的,作者利用两步连续的自然化学连接(Native Chemical Ligation, NCL)反应,构建了四种糖基化修饰的CCL14。通过对四种不同糖基化修饰的CCL14蛋白活性进行表征,作者发现糖基化修饰不影响CCL14全长蛋白与其受体CCR1的结合能力和激活能力。但是唾液酸化修饰会影响蛋白酶对CCL14蛋白N端切割效率进而影响其活性。这表明,糖基化修饰通过调控CCL14从全长蛋白到截短体的转化进而影响其生物学活性。
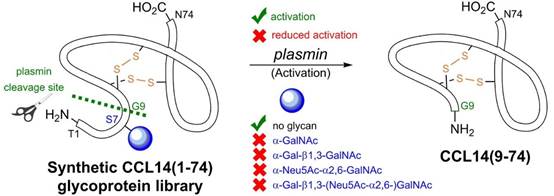
图1.糖基化修饰通过调控CCL14从全长到截短体转化进而影响其生物学活性
趋化因子是一种分泌蛋白,可通过与趋化因子受体结合,从而调控炎症反应过程中白细胞的迁移。CCL14是人体中一种重要的趋化因子,在多种组织中稳定表达。全长的CCL14能够与趋化因子受体CCR1结合,是CCR1的弱激动剂。一系列丝氨酸蛋白酶能够识别并切割CCL14的N端。相比于全长蛋白,CCL14(9-74)N端截短体活性显著增强,能够有效激活趋化因子受体CCR1、CCR5和CCR3下游信号通路。
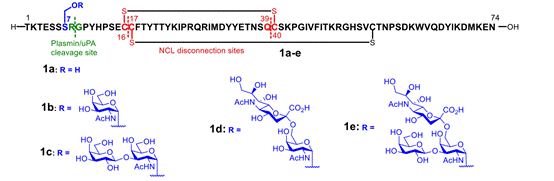
图2.自然化学连接法制备四种糖基化修饰CCL14蛋白
由于CCL14蛋白Ser7临近N端蛋白酶切割位点,且Ser7存在糖基化修饰。为了探究糖基化修饰是如何调控趋化因子CCL14活性的,作者首先利用两步连续的自然化学连接反应,构建了四种带有不同糖基化修饰的CCL14蛋白。他们以无糖基化修饰的CCL14蛋白作为对照,对不同CCL14变体的生物学活性进行探究。
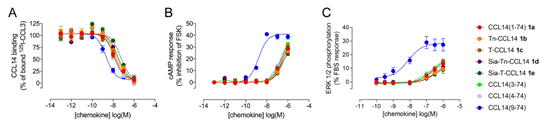
图3.糖基化修饰不影响CCL14全长蛋白与受体的结合能力与激活能力
作者利用四种糖基化的CCL14蛋白测试其与其趋化因子受体CCR1的结合及激活能力。通过稳定表达CCR1蛋白的HEK293T细胞系,作者发现CCL14的N端截短体(9-74)与CCR1具有较强的结合能力,但无糖基化修饰CCL14全长蛋白与受体CCR1结合能力弱7倍。同时,四种不同糖基化修饰均不影响CCL14全长蛋白与其受体的结合能力。
作者同时表征了糖基化修饰的CCL14蛋白对受体的激活能力。当CCL14蛋白与CCR1蛋白结合后,CCR1蛋白下游信号通路激活,抑制cAMP的合成并激活下游磷酸化信号级联反应——ERK1/2磷酸化。通过检测cAMP响应及ERK1/2蛋白磷酸化信号,作者发现:CCL14(9-74)N端截短体可以有效激活CCR1下游信号通路,但全长CCL14蛋白激活能力较弱,且带有不同糖基化修饰的CCL14蛋白也不能有效激活CCR1受体信号通路。
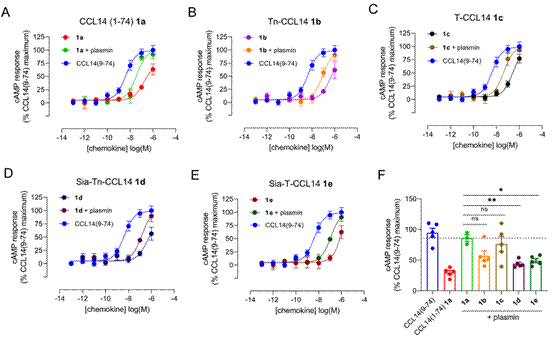
图4.唾液酸化修饰抑制CCL14蛋白N端切割进而影响其生物学活性
最后,作者探究了Ser7位点处不同的糖基化修饰是如何调控CCL14蛋白N端切割效率。CCL14能够被DPP-IV、uPA和plasmin等一系列蛋白酶识别、切割并激活。作者选取了血纤维蛋白溶酶plasmin与不同的CCL14变体共孵育。实验结果显示,无糖基化修饰的CCL14能够被蛋白酶plasmin切割为活性变体,并有效激活CCR1下游信号通路,抑制cAMP合成。而带负电的唾液酸化修饰抑制plasmin切割效率,进而降低其与CCR1受体结合与激活。
综上所述,作者利用自然化学连接反应,化学合成了四种均一的CCL14糖基化变体,为探究糖基化修饰在CCL14结合和信号传导中的作用提供了有效研究手段。作者发现趋化因子CCL14的N端水解和加工对其活性具有十分重要的作用。CCL14糖基化修饰不会影响CCL14全长蛋白的结合和信号传导。而唾液酸化修饰通过调节CCL14的N端蛋白水解效率进而影响其生物学活性。这一机制的阐明对于调节单核细胞向肿瘤的浸润以及炎症疾病的治疗具有十分重要的意义。
