文章标题:Combining Small-Molecule Bioconjugation and Hydrogen-Deuterium Exchange Mass Spectrometry (HDX-MS) to Expose Allostery: the Case of Human Cytochrome P450 3A4
通迅作者:加拿大麦吉尔大学化学系的Karine Auclair与Christopher J. Thibodeaux教授。
蛋白质的变构效应广泛地存在于各种生理过程中。通常情况下,药物或其他效应分子与所对应的蛋白质的作用位点结合,使得蛋白质的结构发生一定程度的变化,进而触发其分子内部相互作用的重组,有时甚至会使得距离作用位点很远的其他位点的功能与活性发生变化。这类效应分子所引发的蛋白质的构象变化在生理代谢与细胞信号转导过程中起到重要的调控作用,也往往成为新药物开发的潜在靶点。然而目前许多酶蛋白动态变构过程的分子机制依然没有被研究清楚,这给我们研究此类生命过程中的具体生物物理学机理造成了阻碍。
基于这一问题,本篇文章的作者们开发出了一种将蛋白质与效应小分子共价连接并结合氢氘交换质谱(Hydrogen-deuterium exchange mass spectrometry, HD-MS)分析的技术,对蛋白质的变构过程进行动态的研究。在本篇工作中,研究人员选择了人的细胞色素P450酶蛋白CYP3A4作为研究对象。人细胞色素P450酶蛋白是一种亚铁血红素的单氧酶,其中的CYP3A4由于参与到大约50%临床药物的代谢过程中而受到广泛的关注,而其与底物结合的多样性与复杂性是由活性位点极强的可塑性所造成的。这种存在着多位点与多底物相互影响的复杂的机制是现有技术很难进行研究的。
在先前的工作中,Karine Auclair课题组通过合成带有马来酰亚胺基团的黄体酮(Progesterone)分子,并将其与不同位点突变为半胱氨酸的CYP3A4蛋白进行共价偶联,从而减弱目标蛋白结合效应分子后的异质性,以便进行后续的动态功能与结构研究。
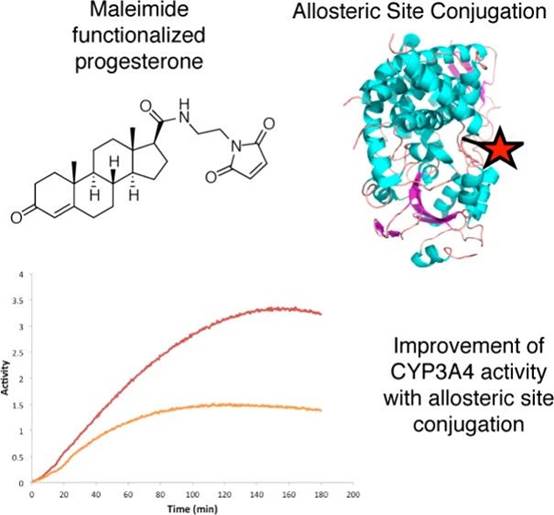
图1.作者团队先前的CYP3A4蛋白与马来酰亚胺黄体酮共价偶联的工作。(图片来源:Bioconjugate Chem. 2017, 28, 885−889. DOI: 10.1021/acs.bioconjchem.6b00604)。
在本篇工作中,作者引入了氢氘交换质谱的技术。这一技术的原理是通过将目的蛋白样品溶解于氘溶剂中,通过对序列中各部分氢氘元素交换的速率进行全局性的检测,从而对蛋白质序列结构的紧密程度进行表征。而通过比较与黄体酮共价前后的氢氘交换质谱结果,我们就可以找出其中同位素交换速率有明显变化的序列区域,从而得到与变构位点以及构象变化相关的结构信息。如图2中所示,作者首先对共价结合了黄体酮的两种CYP3A4突变体(F108C与F215C)进行了氢氘交换质谱分析,其中红色为交换速率变快的区域,蓝色为交换速率变慢的区域,分别表明该区域在共价结合黄体酮后结构变得更加松散或紧密。这一结果给出了两个位点与黄体酮结合后整个蛋白构象变化的详细信息。
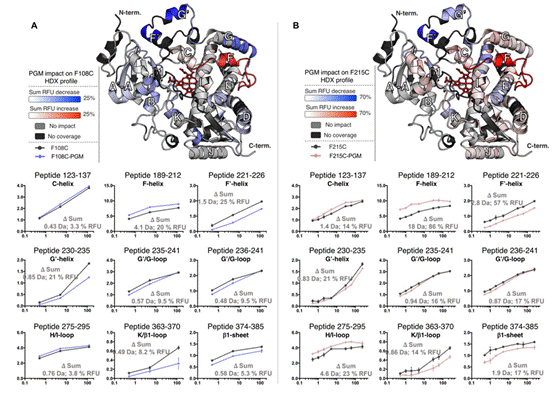
图2.对两种CYP3A4突变体偶联黄体酮前后的氢氘交换速率比较的结果。红色为交换速率变快的区域,表明此区域结合黄体酮后结构变得松散;蓝色为交换速率变慢的区域,表明此区域结合黄体酮后结构变得紧密。
随后作者对另外两种突变体G481C与L482C进行了研究。在先前的工作中,这两种突变体与黄体酮结合后分别表现为对CYP3A4酶活性的拮抗与激活效应。有趣的是,氢氘交换质谱的结果中表明,G481C位点的结合造成变化的区域都表现为蓝色,反之,L482C位点的结合使得变构区域都更加松散。通过两者的比较,作者也总结出了CYP3A4蛋白结构中与酶活性激活/抑制极为相关的区域信息(图3)。
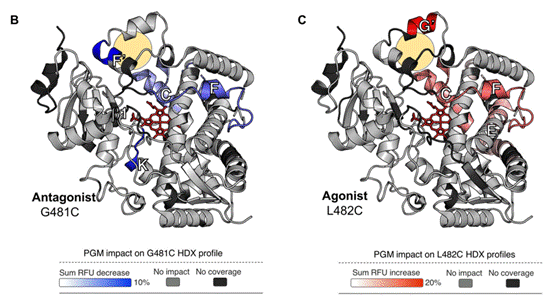
图3.对模拟拮抗与激活的两种突变体的氢氘质谱结果分析。其中拮抗模型带来的构象变化全部为蓝色,而激活模型则完全相反。两者共同的变化区域极有可能是与酶活性密切相关的位置。
随后作者还通过对质谱结果的详细分析,发现了蛋白质结构折叠与氢氘交换的双峰模型,发现蛋白中与活性相关的F'、C、F区域在共价结合了效应分子后存在着更为复杂的变构效应。
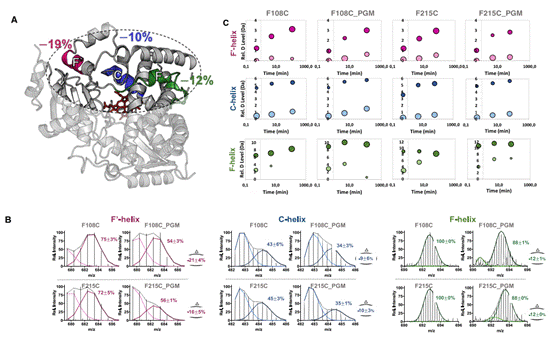
图4.存在双峰交换模式的区域。蛋白质一些区域的折叠-去折叠速率与氢氘交换速率的相对关系在结合效应分子前后存在着变化。CYP3A4蛋白的该区域与变构效应密切相关。
除了变构位点之外,作者通过添加不含马来酰亚胺的黄体酮分子对CYP3A4蛋白的酶活性位点进行了氢氘交换质谱研究。在加入天然的效应分子时,由于变构位点的结合无法通过共价偶联的方式稳定,效应分子会倾向于保留在酶的活性位点附近。作者发现在这种情况下CYP3A4蛋白的构象变化与之前有了很大程度的不同。一些区域信息与先前共价结合变构位点时的结果无法匹配,这一结果也证明了共价结合变构位点是研究小分子影响酶构象的有效手段。
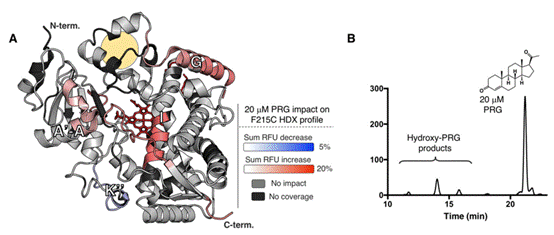
图5.黄体酮结合CYP3A4活性位点时的氢氘交换结果。Hydroxy-PRG证明黄体酮作为底物与酶活性位点结合。这一结构中速率变化区域与先前结合变构位点时有很大不同。
综上所述,作者团队通过将小分子共价偶联与氢氘交换质谱相结合,开发出了一种研究效应小分子作用下蛋白质构象变化的有效方法。通过与蛋白质结构相结合,这一技术可以对蛋白质各区域构象信息进行全面的展现与分析,尤其有望在药物与靶点蛋白的结合机制研究中发挥作用
