作为一种由新型冠状病毒SARS-CoV-2(之前称为2019-nCoV)引起的新兴疾病,COVID-19因具有较高的风险水平而成为全球关注的焦点。人们已发现病原体SARS-CoV-2是β冠状病毒属中与严重急性呼吸综合征(SARS)冠状病毒(SARS-CoV)和蝙蝠冠状病毒RaTG13密切相关的一个成员。
冠状病毒是危险的动物源性病原体之一。本世纪以来,已有两次严重的β冠状病毒病疫情在人类中爆发。它们分别是2003年的SARS和2012年开始的中东呼吸综合征(MERS)。SARS-CoV和中东呼吸综合征(MERS)冠状病毒(MERS-CoV)均为人畜共患病的病原体,由蝙蝠传播到果子狸或单峰骆驼等中间宿主,并最终传播到人类。
冠状病毒是一类正股RNA病毒,病毒颗粒包膜上的刺突(S)糖蛋白(下称S蛋白)通过它的受体结合域(RBD)介导受体识别,并在S蛋白裂解成S1和S2亚基后进行膜融合。受体是决定冠状病毒的宿主嗜性和致病性的主要因素。冠状病毒已经进化出了复杂的受体识别模式。来自亲缘关系较近的冠状病毒的S蛋白可以识别不同的受体,而来自亲缘关系较远的S蛋白可以采用相同的进入受体。比如,SARS-CoV以血管紧张素转换酶2(ACE2)为主要进入受体,MERS-CoV则以跨膜二肽基肽酶4(DPP4,又称为CD26)为主要进入受体。一些报道已提出SARS-CoV-2利用SARS-CoV受体ACE2进入宿主细胞,尽管与SARS-CoV相比,SARS-CoV-2 S蛋白的RBD内5个关键残基中的4个发生了突变。另一种人类冠状病毒NL63也使用ACE2作为它的受体,然而冠状病毒NL63属于α冠状病毒属。此外,根据对病毒基因组特征的分析结果,有人认为SARS-CoV-2的自然宿主是蝙蝠和穿山甲,但还没有证据表明有一种直接将SARS-CoV-2传播给人类的中间动物。
耐人寻味的是,除了主要进入受体外,病毒进入细胞总是需要靶细胞中的多个跨膜蛋白。除指定的进入受体外,冠状病毒S蛋白还能够识别广泛的细胞表面分子。这些分子被称为辅助受体(coreceptor)或附着因子(attachment factor),有报道称它们在病毒传播过程中起着关键作用。细胞对病毒感染的易感性可能与这些蛋白的相互作用有关,它们有助于确保在适当的位置触发病毒进入。
一种冠状病毒的受体可以作为另一种冠状病毒甚至亲缘关系较远的冠状病毒感染的辅助因子(co-factor)。比如,人类冠状病毒OC43(hCoV-OC43)的受体O-乙酰化硅酸已被提出是hCoV-HKU1结合到细胞表面上的一种附着因子。蛋白CEACAM5和GRP78被确定为附着因子,可增强MERS-CoV附着非易感细胞和进入易感细胞。除MERS-CoV之外,GRP78可以同时帮助蝙蝠冠状病毒HKU9进入细胞。与CEACAM5一样,CEACAM1作为动物冠状病毒--小鼠肝炎病毒(MHV)---的受体。此外,四次跨膜蛋白CD9被确定为宿主细胞表面因子,通过作为支架支撑受体DPP4和蛋白酶TMPRSS2来增强MERS-CoV进入细胞。TMPRSS2可以在SARS-CoV、MERS-CoV或SARS-CoV-2的早期感染中作为激活因子(priming factor)发挥作用。就SARS-CoV而言,蛋白DCSIGN和DCSIGN相关分子通过与S蛋白相互作用促进病毒进入细胞。目前仍不清楚冠状病毒是否通过病毒S蛋白的RBD与这些附着因子结合。很少有人关注细胞表面辅助因子在促进SARS-CoV-2附着和进入细胞中的作用。然而对这一方面的研究可能有助于了解病毒发病机制,这在很大程度上仍然是未知的。
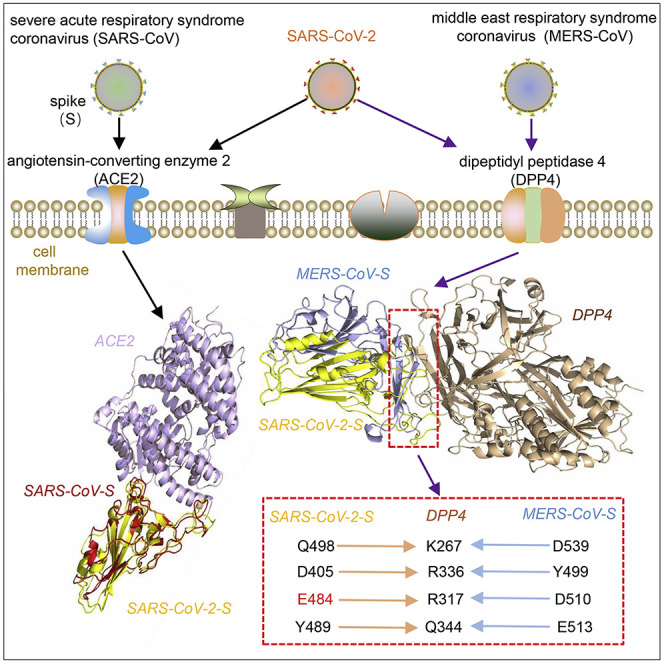
在一项新的研究中,来自中国中南大学和中国农业大学的研究人员利用结合基于晶体结构的人类-病毒相互作用预测和蛋白对接(protein docking)的生物信息学方法揭示了人DPP4与SARS-CoV-2 S蛋白(下称SARS-CoV-2-S)的受体结合结构域(RBD)之前存在较高的亲和力。有趣的是,DPP4参与SARS-CoV-2 RBD结合的关键氨基酸残基与MERS-CoV-S中的完全相同。此外,与SARS-CoV-2-S相比,E484插入和相邻残基的替换应当是SARS-CoV-2-S获得DPP4结合能力的最重要因素。这种潜在利用DPP4作为SARS-CoV-2的结合靶点,可能会对病毒的发病机理提供新的见解,并有助于制定应对COVID-19挑战的监测和治疗策略。相关研究结果于2020年5月14日在线发表在iScience期刊上,论文标题为“The MERS-CoV receptor DPP4 as a candidate binding target of the SARS-CoV-2 spike”。
除识别受体外,冠状病毒通常可识别多种细胞表面靶点。对于MERS-CoV,当受体DPP4和蛋白酶TMPRSS2在细胞表面上稀少时,CD9可以在这种病毒的早期高效进入细胞中发挥重要作用。在融合发生之前,充分的蛋白裂解可能在细胞膜上这些进入因子局部浓度相对较高的区域内导致活化的聚合物形成。这种特征可能使得冠状病毒在建立动物或人类宿主的有效感染方面具有生理优势,从而导致它们的高致病性。随着COVID-19的持续流行,很多临床特征的原因仍然在很大程度上有待研究。针对动物模型的实验表明COVID-19的严重程度似乎介于SARS和MERS之间。而且,就SARS-CoV-2感染而言,受体ACE2与这种病毒的S蛋白的结合并不是最优的。免疫学表征研究已展示了SARS-CoV-2在免疫细胞中的感染,特别地,这种在免疫细胞中的感染与ACE2的表达不相关。因此,看来ACE2在SARS-CoV-2的迅速感染和发病过程中使用了一些辅助因子。
在这项新的研究中,根据结合自由能,ACE2/SARS-CoV-2-S的亲和力强于DPP4/SARS-CoV-2-S(图1A),这提示着ACE2优先与SARS-CoV-2-S结合,ACE2作为主要受体发挥作用。这些作者的研究结果表明,SARS-CoV-2-S和MERS-CoV-S都能与DPP4结合,在界面处共享相同的DPP4关键结合残基(图1)。这些结果还表明E484和相邻残基的插入和替换可能是SARS-CoV-2-S和MERS-CoV-S与DPP4的结合能力完全不同的重要原因,这是因为相邻残基也可能是结构变化的原因。SARS-CoV-2-S和DPP4的结合似乎是独特的。然而,这些类型的突变可以自然发生在蝙蝠冠状病毒毒株RaTG13中,不过这些残基可能是不同的。目前,唯一具有这种潜在结合能力的动物源性β冠状病毒是目前仅从穿山甲中分离出来,它的S蛋白RBD序列中含有这些相同的关键残基。此外,这种模型还评估了与已知的病毒-宿主相互作用(包括SARS-CoV-S/ACE2、MERS-CoV-S/DPP4)相一致的结合位能、界面残基和结构,旨在验证这种新方法的可行性。
DPP4是MERS-CoV受体,因此具有介导冠状病毒感染的优势。已有研究表明,DPP4不能独立介导SARS-CoV-2进入非易感细胞,比如Hela和BHK2。然而,它在SARS-CoV-2感染过程中对病毒附着和/或进入易感细胞的作用仍然是未知的。在这项新研究所采用的方法中,这些作者揭示DPP4可以作为SARS-CoV-2-S RBD的候选结合靶点。DPP4是一种丝氨酸蛋白酶,在人类组织中大量分布,并作为一种多功能蛋白发挥作用。除了下呼吸道、肾脏、肝脏、小肠和前列腺之外,DPP4在胎盘、肺部成纤维细胞、受伤的皮肤、肌肉以及中枢神经系统中均有表达。此外,DPP4在活化的免疫细胞表面上广泛表达,包括CD4+ T细胞和CD8+ T细胞、B细胞、NK细胞、树突细胞和巨噬细胞。它能够调节细胞因子、趋化因子和肽类激素的产生,从而参与各种免疫性或炎症性疾病。但是总体而言,人们必须了解DPP4与主要受体ACE2之间的相互作用,以及DPP4如何可能帮助SARS-CoV-2进入宿主细胞。
丝氨酸蛋白酶抑制剂甲磺酸卡莫司他(camostat mesylate)已被证实虽然出于抑制TMPRSS2的目的而被开发出来,但可有效抑制SARS-CoV-2感染。鉴于DPP4也是一种丝氨酸蛋白酶,因此,即使DPP4是病毒S蛋白的细胞表面靶点,这也将合理地使用这种药物来抑制SARS-CoV-2感染。DPP4抑制剂可能经开发后成为靶向COVID-19的治疗药物。哺乳动物中DPP4的保守属性可能使得SARS-CoV-2在动物病毒库中维持并发生重组事件。因此,在SARS-CoV-2的监测中,有必要考虑广泛多的动物。
总之,基于蛋白晶体结构的生物信息学方法预测MERS-CoV受体DDP4可能作为SARS-CoV-2的候选结合靶点或辅助受体。有趣的是,DPP4与SARS-CoV-2结合的关键氨基酸残基与DPP4结合MERS-CoV-S RBD的残基完全相同。E484及其相邻残基的突变可能是获得这种结合能力的重要原因。这种模型为SARS-CoV-2与宿主之间的相互作用提供了新的见解。围绕这一方面的深入研究可能更好地了解SARS-CoV-2的宿主嗜性和致病性,并有助于制定应对病毒感染挑战的监测和治疗策略。
参考资料:
Yu Li et al. The MERS-CoV receptor DPP4 as a candidate binding target of the SARS-CoV-2 spike. iScience, 2020, doi:10.1016/j.isci.2020.101160.
